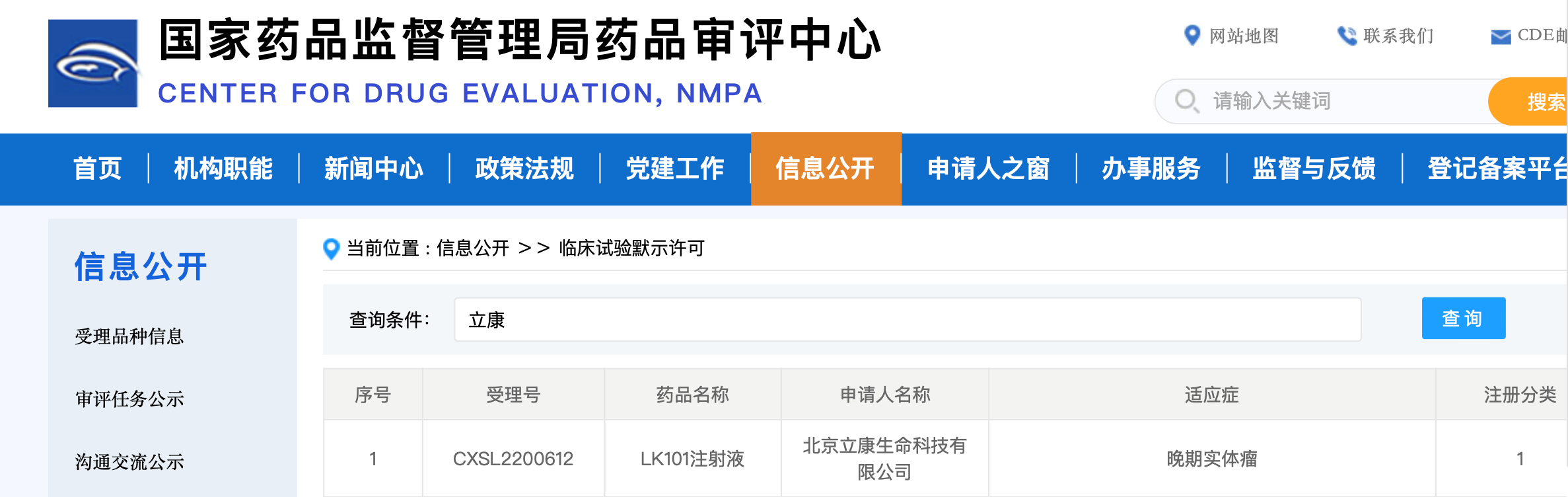
3月15日,国家药品监督管理局药品审评中心网站临床试验默示许可栏更新数据,北京立康生命科技有限公司旗下的个性化肿瘤新生抗原疫苗产品LK101注射液(受理号:CXSL2200612)获临床试验默示许可,适应症是晚期实体瘤。这是中国首个获得NMPA批准进入临床阶段的个性化肿瘤新生抗原疫苗,也是首个获批进入临床阶段的完全个性化的mRNA编辑产品。
在LK101注射液研究整个过程中,中国药科大学新药安全评价研究中心高质量高效率地完成全套非临床研究,包括药效学、药代动力学和安全性评价等研究,并与北京立康一起与NMPA进行技术沟通,最终获批临床试验。
北京立康是一家成立于2017年的个性化肿瘤免疫药物创新企业,创始团队都是本土博士。现已搭建生物信息学平台LNEA(TM)、高通量抗原/T细胞受体筛选平台HATSP(TM)、体外转录mRNA技术平台以及大规模自动化封闭式细胞药物生产平台等。目前,公司聚焦精准肿瘤免疫疗法,正在基于通用型技术平台全线布局肿瘤新生抗原分析诊断、新抗原肿瘤疫苗和T细胞疗法等多条管线,充分挖掘肿瘤新生抗原的潜力。
中国药科大学安评中心可同时进行小鼠、大鼠、豚鼠、兔、犬、猴等动物实验二十余项,支持中国NMPA和美国FDA GLP的IND和NDA注册申报。目前已建设完成新药快速转化的“一站式”创新服务体系,包括药物靶点确证和快速发现平台、非临床安全性评价平台、肿瘤活组织样本库和PDTX药效平台、类器官(芯片)与新药研发平台、创新药临床探索性研究平台、药品临床价值评估和立项平台。以“新药创制+生命健康+生物医药研发快速转化服务平台”为导向,共同推进创新药物研究、加速科技成果转化。